infusionsvätska, emulsion
sojabönolja
Källa: Fass.se
Bipacksedel: Information till användaren
infusionsvätska, emulsion
sojabönolja
Spara denna information, du kan behöva läsa den igen.
Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt 4.
Tillsammans med salter, spårämnen och vitaminer fungerar StructoKabiven som en del av en balanserad intravenös näringstillförsel som tillgodoser hela ditt behov av näring.
StructoKabiven är en emulsion och ges som dropp (intravenös infusion). Läkemedlet består av aminosyror (proteiners byggstenar), glukos, fetter och salter i en påse av plast.
om du är allergisk mot någon av de aktiva substanserna eller något annat innehållsämne i detta läkemedel (anges i avsnitt 6),
om du är allergisk mot produkter som innehåller ägg, soja eller jordnötter. Produkten innehåller sojabönsolja,
om du har för höga fettvärden i blodet (hyperlipidemi),
om du har en svår leversjukdom,
om du har blodlevringsproblem (koagulationsrubbning eller hemofagocyterande syndrom),
om din kropp har svårigheter att använda aminosyror,
om du lider av allvarlig njursjukdom och saknar tillgång till dialys,
om du är i akut chock,
om du har förhöjda blodsockernivåer (hyperglykemi),
om du har förhöjda nivåer i blodet av de salter (elektrolyter) som ingår i StructoKabiven,
om du har vätska i lungorna (akut lungödem),
om du har för mycket vätska i kroppen (hyperhydrering),
om du har obehandlad hjärtsvikt,
om du har för lite vätska i kroppen (hypoton dehydrering),
vid instabila tillstånd t ex efter allvarliga skador, obehandlad diabetes, akut hjärtinfarkt, metabolisk acidos (rubbning i ämnesomsättningen som ger för mycket syra i blodet), svår infektion (svår blodförgiftning) eller koma.
Tala med din läkare innan du får StructoKabiven om du har:
njursjukdom,
diabetes,
pankreatit (bukspottkörtelinflammation),
leversjukdom,
hypotyreoidism (besvär med sköldkörteln),
sepsis (svår infektion, blodförgiftning).
Din läkare kan behöva ta blodprover på dig regelbundet för att säkerställa att Structokabivenbehandlingen fungerar ordentligt.
StructoKabiven är inte avsett för nyfödda barn eller barn som är yngre än 2 år. För barn i åldern 2 till 11 år saknas erfarenhet av behandling med StructoKabiven.
Tala om för läkare eller apotekspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
Tala om för din läkare om du tar
ett läkemedel som kallas heparin som används för att förhindra bildning och underlätta upplösning av blodproppar,
blodförtunnande läkemedel (kumarinderivat) då vitamin K1, som finns i sojabönsolja kan påverka blodets levringsförmåga,
insulin för behandling av diabetes.
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du får detta läkemedel.
StructoKabiven bör endast användas under graviditet efter särskilt övervägande.
Kvinnor som behandlas med StruktoKabiven bör inte amma.
Inga effekter på förmågan att framföra fordon och använda maskiner förväntas.
Denna medicinska produkt innehåller sojabönolja, vilket i ovanliga fall kan orsaka allvarliga allergiska reaktioner. Korsallergiska reaktioner har observerats mellan sojaböna och jordnöt.
Din läkare bestämmer dosen utifrån din kroppsvikt samt kroppsfunktion. StructoKabiven kommer att ges till dig av sjukvårdspersonal. Ditt läkemedel kommer enbart att ges via en central ven.
Eventuellt blir du övervakad under behandlingen.
Det är inte troligt att du får för mycket läkemedel, eftersom sjukvårdspersonalen kommer att övervaka dig under behandlingen. Effekter av en överdosering kan vara illamående, feber, kräkningar, frossa, svettning och vätskeretention. Hyperglykemi (förhöjda blodsockernivåer) och elektrolytrubbningar har också rapporterats.
Om du får en för hög dos StructoKabiven finns det risk för att du får i dig för mycket fett. Detta kallas ”fat overload syndrome”. Mer information finns i avsnitt 4, ”Eventuella biverkningar”.
Om du upplever något av de ovan beskrivna symtomen eller tror att du har fått för mycket StructoKabiven, säg genast till din läkare eller sjuksköterska. Infusionen kommer att avbrytas eller fortsätta men med lägre dosering. Vanligtvis försvinner symtomen när infusionen avbryts eller när infusionshastigheten minskas.
Om du har ytterligare frågor om användningen av denna produkt, kontakta sjukvårdspersonalen.
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Säg genast till sjukvårdspersonalen om du under infusionen får feber, utslag, svullen tunga eller hals, andningssvårigheter, frossa, svettningar, illamående eller kräkningar. Dessa symtom kan vara en allergisk reaktion orsakad av läkemedlet.
Andra biverkningar inkluderar:
Mindre vanliga (kan förekomma hos upp till 1 av 100 personer): fler enzymer än vanligt som visar hur levern fungerar, illamående, huvudvärk, ökad kroppstemperatur.
Sällsynta (kan förekomma hos upp till 1 av 1000 personer): hjärtklappning (takykardi), högt blodtryck.
Mycket sällsynta (kan förekomma hos upp till 1 av 10 000 personer): andningssvårigheter, diarré, utslag, ryggvärk, yrsel.
”Fat overload syndrome”
Om din kropp får problem med att hantera fett på grund av att du har fått för mycket StructoKabiven kan du drabbas av ”fat overload syndrome”. Problemet kan också uppstå på grund av en snabb förändring av ditt tillstånd (t.ex. njurproblem eller en infektion). Möjliga symtom är feber, hög fetthalt i blodet (hyperlipidemi), cellerna och vävnaderna, störningar i olika organ och koma. Symptomen försvinner vanligtvis om infusionen avbryts.
Överskott av aminosyror
Detta kan inträffa när infusionshastigheten ökar och nivån av aminosyror överskrids. Möjliga symtom är illamående, kräkningar, frossa, svettningar och ökning av kroppstemperaturen. Om du har problem med njurarna kommer din läkare eventuellt vilja göra ett blodprov för att undersöka mängden kväveinnehållande substanser i ditt blod.
Överskott av glukos
Detta kan inträffa när din kropp har svårigheter att göra sig av med glukos vilket orsakar för höga blodsockernivåer (hyperglykemi).
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera eventuella biverkningar direkt till Läkemedelsverket, www.lakemedelsverket.se. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Läkemedelsverket
Box 26
751 03 Uppsala
Förvara detta läkemedel utom syn- och räckhåll för barn.
Förvaras vid högst 25°C.
Får ej frysas.
Låt ytterpåsen sitta kvar under förvaring.
Används före utgångsdatum som anges på förpackningen. Utgångsdatumet är den sista dagen i angiven månad.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
986 ml | 1477 ml | 1970 ml | Per 1000 ml | |
Aminosyralösning med elektrolyter | 500 ml | 750 ml | 1000 ml | 508 ml |
Glukos 420 mg/ml | 298 ml | 446 ml | 595 ml | 302 ml |
Fettemulsion | 188 ml | 281 ml | 375 ml | 190 ml |
Vilket motsvarar följande totalinnehåll: | ||||
De aktiva substanserna är: | 986 ml | 1477 ml | 1970 ml | Per 1000 ml |
Renad strukturerad triglycerid | 38 g | 56 g | 75 g | 38,5 g |
Glukos (som monohydrat) | 125 g | 187 g | 250 g | 127 g |
Alanin | 7,0 g | 10,5 g | 14,0 g | 7,1 g |
Arginin | 6,0 g | 9,0 g | 12,0 g | 6,1 g |
Glycin | 5,5 g | 8,2 g | 11,0 g | 5,6 g |
Histidin | 1,5 g | 2,2 g | 3,0 g | 1,5 g |
Isoleucin | 2,5 g | 3,8 g | 5,0 g | 2,5 g |
Leucin | 3,7 g | 5,6 g | 7,4 g | 3,8 g |
Lysin (som acetat) | 3,3 g | 5,0 g | 6,6 g | 3,4 g |
Metionin | 2,2 g | 3,2 g | 4,3 g | 2,2 g |
Fenylalanin | 2,6 g | 3,8 g | 5,1 g | 2,6 g |
Prolin | 5,6 g | 8,4 g | 11,2 g | 5,7 g |
Serin | 3,2 g | 4,9 g | 6,5 g | 3,3 g |
Taurin | 0,5 g | 0,75 g | 1,0 g | 0,5 g |
Treonin | 2,2 g | 3,3 g | 4,4 g | 2,2 g |
Tryptofan | 1,0 g | 1,5 g | 2,0 g | 1,0 g |
Tyrosin | 0,20 g | 0,30 g | 0,40 g | 0,20 g |
Valin | 3,1 g | 4,6 g | 6,2 g | 3,1 g |
Kalciumklorid (som Kalciumkloriddihydrat) | 0,28 g | 0,42 g | 0,56 g | 0,28 g |
Natriumglycerofosfat (som hydrat) | 2,1 g | 3,1 g | 4,2 g | 2,13 g |
Magnesiumsulfat (som Magnesiumsulfatheptahydrat) | 0,60 g | 0,90 g | 1,2 g | 0,61 g |
Kaliumklorid | 2,2 g | 3,4 g | 4,5 g | 2,3 g |
Natriumacetat (som natriumacetattrihydrat) | 1,7 g | 2,6 g | 3,4 g | 1,7 g |
Zinksulfat (som Zinksulfatheptahydrat) | 0,0065 g | 0,0097 g | 0,013 g | 0,0066 g |
Övriga innehållsämnen är:
Glycerol
Renade äggfosfolipider
Natriumhydroxid (pH-justering)
Isättika (pH-justering)
Saltsyra (pH-justering)
Vatten för injektionvätskor.
Glukos- och aminosyralösningarna är klara, färglösa eller svagt gula och fria från partiklar. Fettemulsionen är vit och homogen.
Förpackningsstorlekar:
1 x 986 ml, 4 x 986 ml
1 x 1477 ml, 4 x 1477 ml
1 x 1970 ml, 2 x 1970 ml (Excel), 4 x 1970 ml (Biofine)
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning:
Fresenius Kabi AB, SE-751 74 Uppsala, Sverige
Tillverkare:
Fresenius Kabi AB
751 74 Uppsala,
eller
Fresenius Kabi Austria GmbH
Hafnerstrasse 36
8055 Graz, Österrike
Denna bipacksedel ändrades senast: 2015-05-07
Varningar och försiktighet
För att undvika risker förenade med för höga infusionshastigheter rekommenderas en kontinuerlig och välkontrollerad infusion, om möjligt administrerad med hjälp av en volumetrisk pump.
På grund av ökad risk för infektioner vid infusion i central ven skall strikt aseptisk teknik tillämpas för att undvika kontaminering, särskilt vid kateterinläggning och dess skötsel.
Serumglukos, elektrolyter och osmolaritet samt vätskebalans, syra-bas status och lever- och enzymtester bör kontrolleras.
Vid varje tecken på anafylaktisk reaktion (såsom feber, frossa, utslag eller andnöd) skall infusionen omedelbart avbrytas.
StructoKabiven skall inte ges parallellt med blod via samma infusionsset på grund av risken för pseudoagglutinering.
Administreringssätt
Intravenös användning, infusion i central ven.
För total parenteral nutrition bör spårämnen, och vitaminer tillsättas till StructoKabiven efter patientens behov.
Infusionshastighet
Maximal infusionshastighet för glukos är 0,25 g/kg/timme, för aminosyror 0,1 g/kg/timme och för fett 0,15 g/kg/timme.
Infusionshastigheten skall inte överstiga 2,0 ml/kg/timme (motsvarande 0,25 g glukos, 0,1 g aminosyror och 0,08 g fett/kg/timme). Rekommenderad infusionstid är 14-24 timmar.
Anvisningar för användning och hantering
Produkten skall inte användas om förpackningen är skadad. Använd innehållet endast om aminosyra- och glukoslösningarna är klara och färglösa eller svagt gula och om fettemulsionen är vit och homogen. Innehållet i de tre separata kamrarna måste blandas före användning samt före tillsatser via tillsatsporten.
Efter förslutningssvetsarnas öppnande skall innerpåsen vändas ett antal gånger för att säkerställa en homogen blandning som inte uppvisar något som helst tecken på fasseparation.
Enbart för engångsbruk. Ej använt läkemedel och avfall skall kasseras enligt gällande anvisningar.
Tillsatser
Endast läkemedels- eller nutritionslösningar för vilka blandbarhet har dokumenterats får tillsättas till StructoKabiven. Blandbarhetsdata för ett antal tillsatser och förvaringstider för olika blandningar tillhandahålles på förfrågan.
Tillsatser skall utföras aseptiskt.
Hållbarhet
Hållbarhet efter blandning:
Vid användning av den blandade trekammarpåsen har kemisk och fysikalisk stabilitet visats i 36 timmar vid 25ºC. Ur mikrobiologisk synvinkel ska infusionsvätskan användas omedelbart. Om produkten inte används omedelbart är användaren ansvarig för lagringstid och lagringsförhållanden och dessa skall normalt inte överstiga 24 timmar vid 2-8ºC.
Hållbarhet efter tillsatser
Om tillsatser görs ska blandningarna av mikrobiologiska skäl användas direkt. Om blandningarna inte används omedelbart efter beredning är lagringstid och förvaringsförhållanden före administrering användarens ansvar. Förvaringstiden ska normalt inte överskrida 24 timmar vid 2-8ºC.
StructoKabiven
Bruksanvisning
Påsen
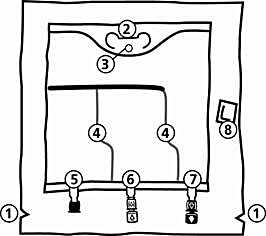
Rivmarkering i ytterpåsen
Handtag
Hål för upphängning av påsen
Svagsvetsar
Blindport (används bara under tillverkning)
Tillsatsport (vit)
Infusionsport (blå)
Syreabsorbator
1. Avlägsnande av ytterpåsen
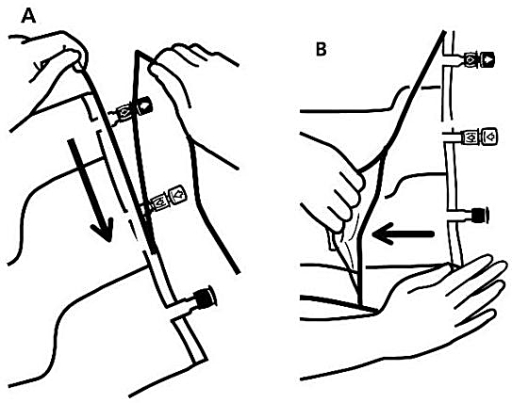
För att ta av ytterpåsen, håll påsen horisontellt och dra från rivmarkeringen intill portarna längs den övre kanten (Bild A).
Dra sedan längs hela långsidan, ta av ytterpåsen och släng den tillsammans med syreabsorbatorn (Bild B).
2. Blandning
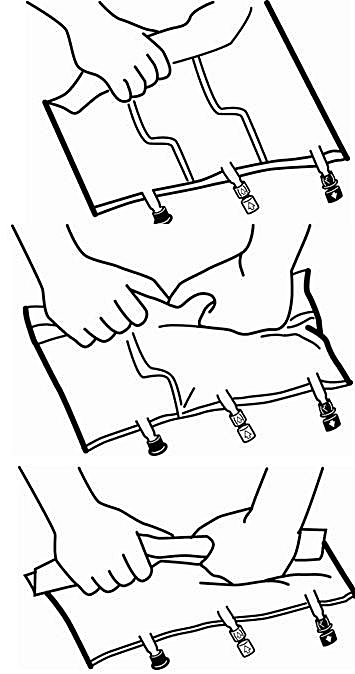
Lägg påsen på en plan yta.
Rulla ihop påsen ordentligt, från handtagssidan mot portarna, först med högerhanden och sedan genom att oavbrutet trycka med vänsterhanden tills de vertikala svagsvetsarna öppnas. De vertikala svagsvetsarna öppnas med hjälp av trycket från vätskan. Svagsvetsarna kan även öppnas innan ytterpåsen avlägsnas.
Observera: Den horisontella förslutningssvetsen ska inte brytas. Lösningarna kan blandas lätt även när den horisontella förslutningen är stängd.
Blanda innehållet i de tre kamrarna noggrant genom att vända påsen tre gånger.
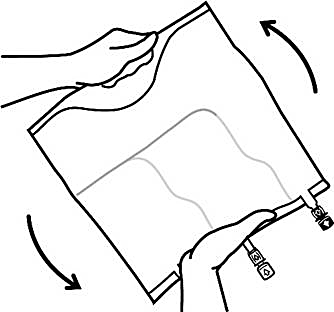
3. Slutförande av beredningen
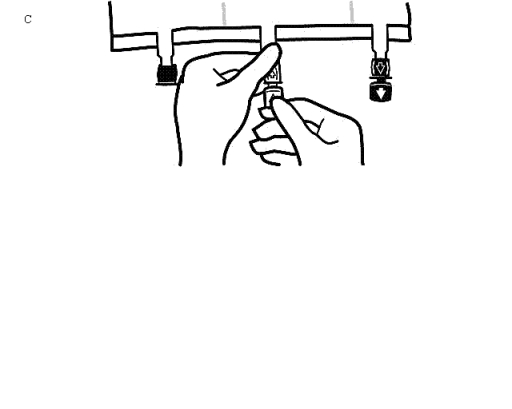
Lägg påsen på en plan yta igen. Omedelbart innan injektion av tillsatser görs, avlägsna förseglingen från den vita tillsatsporten (Bild C).
Observera: Tillsatsportens membran är sterilt
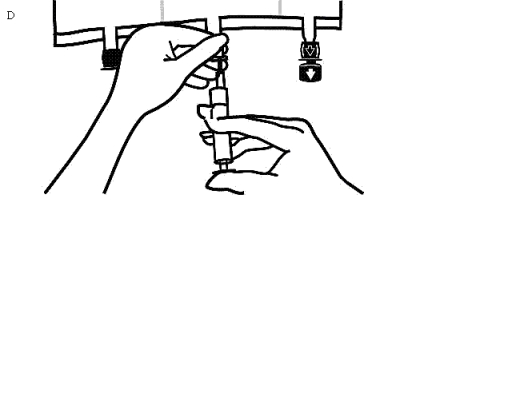
Håll i tillsatsporten, stick in nålen och injicera tillsatslösningen (med känd blandbarhet) genom mitten av injektionsstället (Bild D).
Blanda noggrant mellan varje injektion genom att vända påsen tre gånger. Använd sprutor med nålar av storleken 18-23 gauge och en maximal längd på 40 mm.
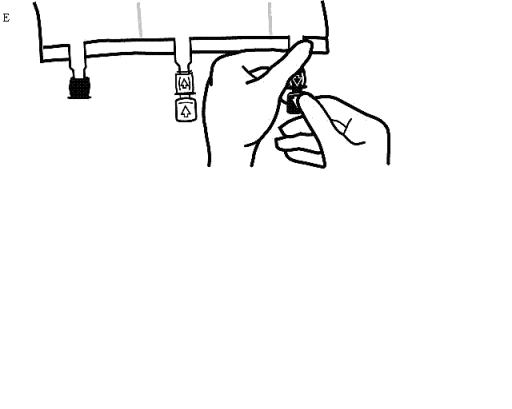
Omedelbart innan infusionsaggregatet förs in, ta av förseglingen från den blåa infusionsporten (Bild E).
Observera: Infusionsportens membran är sterilt.
Använd ickeluftade infusionsaggregat eller stäng luftningsventilen på ett luftat set.
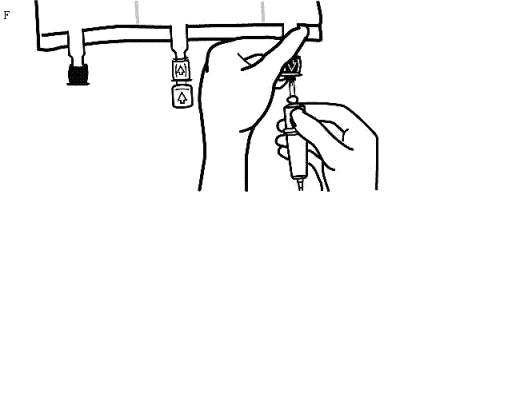
Håll i infusionsporten.
Tryck in spetsen genom infusionsportens skyddshinna. Hela spetsen måste vara inne för att säkerställa dess placering (Bild F).
Observera: Innerdelen av infusionsporten är steril
4. Upphängning av påsen
Häng upp påsen i hålet under handtaget.