4 mg pulver till koncentrat till infusionsvätska, dispersion
mifamurtid
Källa: Fass.se
Bipacksedel: Information till användaren
4 mg pulver till koncentrat till infusionsvätska, dispersion
mifamurtid
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare.
- Om du får biverkningar, tala med din läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt 4.
I denna bipacksedel finner du information om:MEPACT innehåller den aktiva substansen mifamurtid, som liknar en beståndsdel i cellväggen hos vissa bakterier. Det stimulerar ditt immunsystem, så att din kropp får hjälp att döda tumörcellerna.
MEPACT används för behandling av osteosarkom (skelettcancer) hos barn, ungdomar och unga vuxna (mellan 2 och 30 år gamla). Det används efter att du har fått tumören borttagen genom operation och tillsammans med kemoterapi för att döda återstående cancerceller för att minska risken för att cancern ska komma tillbaka.
om du är allergisk mot mifamurtid eller mot något av övriga innehållsämnen i detta läkemedel (anges i avsnitt 6).
om du tar läkemedel innehållande ciklosporin eller andra kalcineurinhämmare eller höga doser av icke-steroida antiinflammatoriska medel (NSAID) (läs avsnittet ”Användning av andra läkemedel” nedan).
Tala med läkare innan du använder MEPACT:
om du har eller har haft problem med hjärta eller blodkärl, såsom blodproppar (trombos), blödningar eller inflammation i venerna (vaskulit). Du bör övervakas mer noggrant under tiden du får MEPACT-behandling. Om du har långvariga eller förvärrade symtom ska du kontakta din läkare, eftersom MEPACT-behandlingen kan behöva uppskjutas eller avbrytas.
om du har haft astma eller andra andningsstörningar. Innan MEPACT används ska du diskutera med din läkare om du bör ta läkemedel mot din astma när MEPACT används.
om du har haft en inflammation eller autoimmun sjukdom eller om du har behandlats med kortikosteroider eller andra läkemedel som kan påverka ditt immunsystem.
om du har fått allergiska reaktioner (hudutslag, andnöd, högt blodtryck) av andra mediciner. Om du upplever att symtomen förvärras ska du kontakta din läkare eftersom dessa kan ha orsakats av MEPACT.
om du har magproblem såsom illamående , kräkningar och förlorad aptit. Om problemen förvärras ska du kontakta din läkare eftersom de kan ha orsakats av MEPACT vid samtidigt användning av kemoterapi.
om du får frossa eller skakningar eller känner dig varm. Mät din kroppstemperatur (ta tempen) eftersom du kan ha feber. Ett lågt antal vita blodkroppar (neutropeni) kan vara ett tecken på en allvarlig infektion.
I avsnitt 4 kan du läsa mer detaljerad information om varningar och försiktigheter kopplade till biverkningar som kan upplevas i samband med att du får den här medicinen.
Tala om för din läkare om du tar eller nyligen har tagit eller planerar att ta andra läkemedel. Detta gäller även receptfria läkemedel. Det är särskilt viktigt att du talar om för din läkare om du tar läkemedel som innehåller någon av följande aktiva substanser:
ciklosporin, takrolimus, som används efter transplantation för att förhindra avstötning av transplanterade organ eller andra immunosuppresiva läkemedel som används t.ex. för att behandla psoriasis (en hudsjukdom).
icke-steroida antiinflammatoriska medel (NSAID), såsom acetylsalicylsyra, ibuprofen eller diklofenak som används för att behandla huvudvärk, feber eller smärta. Använd inte MEPACT om du tar höga doser av icke-steroida antiinflammatoriska medel (NSAID).
kortikosteroider som används för behandling av inflammationer, allergier eller astma. Regelbunden användning av kortikosteroider bör undvikas när du använder MEPACT eftersom det kan påverka hur medicinen fungerar.
Det rekommenderas att tidpunkterna för administrering av MEPACT och doxorubicin eller andra läkemedel separeras om de används i samma kemoterapeutiska behandlingsregim.
Ge inte den här medicinen till barn under 2 år eftersom information saknas om hur säker medicinen är och hur bra den verkar för den här åldersgruppen.
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan du tar detta läkemedel.
MEPACT har inte undersökts hos gravida kvinnor. MEPACT ska därför inte användas under graviditet eller av fertila kvinnor som inte använder en effektiv preventivmetod.
Du ska använda en effektiv preventivmetod om du behandlas med MEPACT.
Det är inte känt om MEPACT går över i bröstmjölk. Om du ammar ska du diskutera med din läkare.
Vissa mycket vanliga eller vanliga biverkningar av MEPACT-behandling (såsom yrsel, svindel, trötthet och dimsyn) kan påverka din förmåga att framföra fordon och använda maskiner.
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per dosenhet, d.v.s. är näst intill ”natriumfritt”.
MEPACT ska bara administreras under översyn av specialistläkare. Använd alltid medicinen exakt enligt din läkares anvisning. Fråga din doktor om du är osäker.
Den rekommenderade dosen MEPACT är 2 mg mifamurtid/m2 kroppsyta. Det ges två gånger i veckan (med minst tre dagars mellanrum) under de första 12 veckorna, därefter en gång i veckan i ytterligare 24 veckor.
Behandlingsschemat för MEPACT kan anpassas för att passa ditt kemoterapischema. Det är inte nödvändigt att avbryta behandlingsschemat för MEPACT om din kemoterapi skjuts upp. Du ska fullfölja 36 veckors (9 månaders) behandling med MEPACT utan avbrott.
Det frystorkade pulvret måste beredas till en vätskesuspension, filtreras med hjälp av det medföljande filtret och spädas ytterligare före användning. MEPACT ges därefter som infusion (dropp) direkt in i en ven (intravenöst) under omkring 1 timme. Detta utförs av din läkare eller en sköterska, som också kommer att övervaka dig under denna tid. Du behöver inte läggas in på sjukhus för att få MEPACT. Det kan också administreras till en öppenvårdspatient.
Du kan drabbas av allvarligare biverkningar, däribland feber, frossbrytningar, trötthet, illamående, kräkningar, huvudvärk och lågt eller högt blodtryck. Vid en sådan överdos, kontakta din läkare eller närmaste sjukhus.
Du bör inte upphöra med MEPACT-behandlingen innan behandlingsschemat är avslutat utan att först diskutera med din läkare. Om du har ytterligare frågor om detta läkemedel kontakta din läkare.
Liksom alla läkemedel kan MEPACT orsaka biverkningar men alla användare behöver inte få dem.
De flesta patienter drabbas av frossbrytningar, feber och trötthet, framför allt under den första administreringen av MEPACT. Dessa biverkningar är vanligtvis lindriga till måttliga och övergående och de kan vanligtvis behandlas av din läkare, till exempel med paracetamol mot feber.
Användandet av MEPACT samtidigt med kemoterapi kan ofta orsaka magproblem såsom illamående, kräkningar och förlorad aptit.
Kontakta omedelbart din läkare
om du får ihållande feber eller frossbrytningar i mer än 8 timmar efter din dos av MEPACT, eftersom detta kan vara ett tecken på en infektion eller
om du får hudutslag eller får svårt att andas (väsande andning).
om du får magproblem.
Mycket vanliga biverkningar (kan förekomma hos fler än 1 av 10 patienter):
feber, skakningar/skälvningar, svaghet, trötthet eller allmänt obehag
illamående och/eller kräkningar, diarré eller förstoppning
huvudvärk eller yrsel
snabba hjärtslag
högt blodtryck eller lågt blodtryck
ingen matlust
svettning
smärta, däribland allmän smärta, smärta i muskler och/eller leder samt smärta i rygg, bröstkorg, buk, armar eller ben
hosta, andningssvårigheter eller snabb andning
låg kroppstemperatur
lågt antal röda blodkroppar.
Vanliga biverkningar (kan förekomma hos upp till 1 av 10 patienter):
blåfärgning av vävnader såsom hud eller tandkött på grund av för lite syre
märkbar ökning av hjärtslagens frekvens eller kraft
svullnad i armar eller ben eller annan svullnad
obehag i bröstkorgen
magbesvär, minskad aptit eller viktförlust
rodnad, svullnad, infektion eller annan lokal reaktion på injektionsstället.
hudutslag eller rodnad, hudinflammation, klåda, torr hud, blekhet eller övergående rodnad
inflammation i hud, senor, muskler eller likartade vävnader som ger stöd åt kroppen
inflammation i en ven
smärta i övre delen av buken eller bröstkorgsväggen, uppsvälld eller smärtande buk, matsmältningsbesvär eller smärtor i levern
annan smärta, däribland smärtor i nacke, skuldror, ljumskar, skelett eller strupe, smärtor efter en operation
kramper eller stelhet i muskler
frusenhet
trötthetskänsla, dåsighet eller sömnighet
brännande, stickande/svidande känsla, minskad känslighet för sinnesförnimmelser, eller känner sinnesförnimmelser utan stimulans
ofrivilliga skakningar
uttorkning
låg kaliumkoncentration i blodet
slemhinneinflammation
täppt eller inflammerad näsa, hals eller bihålor
infektioner i de övre luftvägarna (såsom förkylning) eller urinvägarna (såsom blåskatarr)
allmän infektion
Herpes simplex (virus)-infektion
produktiv hosta (slemhosta), väsande andning eller ansträngd andning eller försämrad andfåddhet
blodspottning eller näsblod
vätska i brösthålan
blod i urinen, svårigheter eller smärtor vid urinering eller täta urineringar.
sömnsvårigheter, depression, ångest eller förvirring
yrsel
öronringning
dimsyn
håravfall
svår, smärtsam menstruation
hörselförlust
lågt antal vita blodkroppar med eller utan feber, lågt antal blodplättar.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera eventuella biverkningar direkt till Läkemedelsverket, www.lakemedelsverket.se. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Läkemedelsverket
Box 26
751 03 Uppsala
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på injektionsflaskans etikett och kartongen efter ”EXP”. Utgångsdatumet är den sista dagen i angiven månad.
Oöppnad injektionsflaska
Förvaras i kylskåp (2°C–8°C). Får ej frysas.
Förvara injektionsflaskan i ytterkartongen. Ljuskänsligt.
Färdigberedd suspension
När läkemedlet har beretts i natriumkloridlösning 9 mg/ml (0,9%), förvaras det vid rumstemperatur (ungefär 20ºC–25ºC) och används inom 6 timmar.
Använd inte detta läkemedel om det finns synliga tecken på försämringar.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Dessa åtgärder är till för att skydda miljön.
Den aktiva substansen är mifamurtid. Varje injektionsflaska innehåller 4 mg mifamurtid. Efter beredning innehåller varje ml suspension 0,08 mg mifamurtid.
Övriga innehållsämnen är 1-palmitoyl-2-oleoyl-sn-glycero-3-fosfokolin (POPC) och 1,2-dioleoyl-sn-glycero-3-fosfo-L-serinmononatriumsalt (OOPS). Se avsnitt 2 ” MEPACT innehåller natrium”.
MEPACT är ett vit till benvit homogen kaka eller pulver till koncentrat till infusionsvätska, dispersion.
MEPACT levereras i en kartong som innehåller
en 50 ml injektionsflaska med grå butylpropp, aluminiumförsegling och skyddslock av plast,
ett sterilt filter för MEPACT som levereras i blister.
Innehavare av godkännande för försäljning
Takeda France SAS
16 Place de l’Iris
92400 Courbevoie
Frankrike
Tillverkare
Takeda Austria GmbH
St. Peter‑Straβe 25
A‑4020 Linz
Österrike
Delpharm Novara S.r.l.
Via Crosa, 86
28065 Cerano (NO)
Italien
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Sverige
Takeda Pharma AB
Tel: 020 795 079
medinfoEMEA@takeda.com
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats: http://www.ema.europa.eu/
Instruktioner för beredning av MEPACT för intravenös infusion
Material som medföljer varje förpackning -
1 injektionsflaska med MEPACT (mifamurtid)
1 filter för MEPACT
Material som behövs men inte medföljer -
Natriumkloridlösning 9 mg/ml (0,9%) för injektion, 100 ml påse
1 steril 60 eller 100 ml engångsspruta med Luer-lock-fattning
2 medelgrova (18 G) sterila injektionsnålar
Det rekommenderas att beredningen av liposomsuspensionen sker i ett skåp med laminärt luftflöde med användning av sterila handskar och aseptisk teknik.
Det frystorkade pulvret ska tillåtas anta en temperatur på ca 20°C–25°C före beredning, filtrering med det medföljande filtret och spädning. Detta tar ungefär 30 minuter.
1. Injektionsflaskans lock ska tas av och proppen rengöras med hjälp av en spritsudd.
2. Filtret ska tas ut ur blisterförpackningen och locket tas av från filterspetsen. Spetsen ska därefter föras in i injektionsflaskans septum tills den sitter fast. Locket på filtrets Lueranslutning ska inte tas bort ännu.
3. Påsen med 100 ml natriumkloridlösning 9 mg/ml (0,9%) för injektion, nål och spruta ska packas upp (medföljer inte förpackningen).
4. Det ställe på påsen med natriumkloridlösning 9 mg/ml (0,9%) för injektion där nålen ska stickas in ska torkas av med en spritsudd.
5. Med hjälp av nålen och sprutan ska 50 ml natriumkloridlösning 9 mg/ml (0,9%) för injektion dras upp från påsen.
6. Efter att nålen har avlägsnats från sprutan ska sprutan fästas på filtret genom att öppna locket på filtrets Luer-anslutning (bild 1).

Bild 1
7. Natriumkloridlösningen 9 mg/ml (0,9%) för injektion ska tillsättas i injektionsflaskan genom långsam, bestämd nedtryckning av sprutkolven. Filtret och sprutan får inte avlägsnas från injektionsflaskan.
8. Injektionsflaskan ska stå orörd i 1 minut för att säkerställa fullständig hydratisering av den torra substansen.
9. Injektionsflaskan ska därefter skakas kraftigt i 1 minut med fastsatt filter och spruta. Under denna tid bildas liposomerna spontant (bild 2).
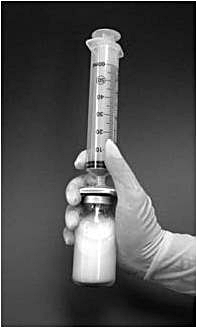
Bild 2
10. Önskad dos kan dras upp från injektionsflaskan genom att vända injektionsflaskan upp och ned och långsamt dra tillbaka sprutkolven (bild 3). Varje ml färdigberedd suspension innehåller 0,08 mg mifamurtid. Den volym suspension som ska dras upp för olika dosmängder beräknas enligt följande:
Volym som ska dras upp = [12,5 x beräknad dos (mg)] ml
För bekvämlighetens skull tillhandahålls följande konkordanstabell:
Dos | Volym |
|---|---|
1,0 mg | 12,5 ml |
2,0 mg | 25 ml |
3,0 mg | 37,5 ml |
4,0 mg | 50 ml |
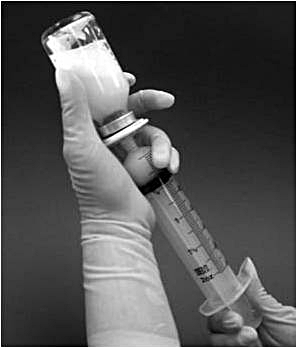
Bild 3
11. Sprutan ska därefter tas bort från filtret och en ny nål placeras på den suspensionsfyllda sprutan. Påsens injektionsställe torkas med en spritsudd och suspensionen i sprutan injiceras i originalpåsen innehållande återstående 50 ml natriumkloridlösning 9 mg/ml (0,9%) för injektion (bild 4).
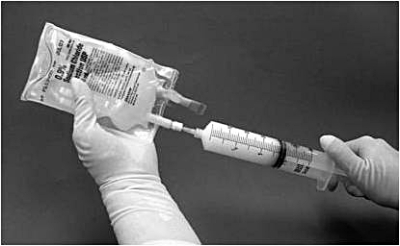
Bild 4
12. Påsen ska snurras försiktigt så att lösningen blandas.
13. Patientidentifikation, tid och datum skrivs på etiketten på påsen som innehåller den färdigberedda, filtrerade och utspädda liposomsuspensionen.
14. Kemisk och fysikalisk stabilitet vid användning har visats för 6 timmar vid rumstemperatur (ca 20°C–25°C).
15. Ur mikrobiologisk synvinkel ska produkten användas omedelbart. Om den inte används omedelbart, är förvaringstid vid användning och förhållanden före användning användarens ansvar, och ska normalt inte vara längre än 6 timmar vid rumstemperatur.
Inga särskilda anvisningar för destruktion.
Denna bipacksedel godkändes senast: 07/2025