500 IE FVIII / 1200 IE VWF och 1000 IE FVIII / 2400 IE VWF pulver och vätska till injektions-/infusionsvätska, lösning
Human koagulationsfaktor VIII / von Willebrand-faktor (VWF)
Källa: Fass.se
Bipacksedel: Information till användaren
500 IE FVIII / 1200 IE VWF och 1000 IE FVIII / 2400 IE VWF pulver och vätska till injektions-/infusionsvätska, lösning
Human koagulationsfaktor VIII / von Willebrand-faktor (VWF)
Spara denna information, du kan behöva läsa den igen.
Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt 4.
Haemate innehåller human koagulations faktor VIII och von Willebrand-faktor. Dessa faktorer är nödvändiga för att blodet ska kunna levra sig. Haemate ersätter brist på kroppseget faktor VIII och von Willebrand-faktor. Blödningar kan då stoppas eller förebyggas.
Haemate används för att förebygga och behandla blödningar hos patienter med:
von Willebrands sjukdom där behandling med desmopressin ej är tillräcklig.
hemofili A (medfödd faktor VIII-brist),
förvärvad faktor VIII-brist
Haemate används också för behandling av patienter med antikroppar mot faktor VIII.
Då Haemate innehåller både faktor VIII och von Willebrand-faktor kommer läkaren att ta hänsyn till vilken av dessa faktorer du behöver mest av. Om du har hemofili A eller andra sjukdomstillstånd med faktor VIII-brist anpassas din dos efter ditt behov av faktor VIII. Om du har von Willebrands sjukdom anpassas din dos efter ditt behov av von Willebrand-faktorn.
Von Willebrand faktor och human koagulationsfaktor VIII som finns i Haemate kan också vara godkänd för att behandla andra sjukdomar som inte nämns i denna produktinformation. Fråga läkare, apotekspersonal eller annan hälso- och sjukvårdspersonal om du har ytterligare frågor och följ alltid deras instruktion.
Om du är allergisk mot von Willebrand-faktorn eller koagulationsfaktor VIII eller något annat innehållsämne i detta läkemedel (anges i avsnitt 6).
Spårbarhet
Varje gång du ges Haemate rekommenderas att produktnamn och satsnummer registreras för att möjliggöra spårandet av använd produkt.
Tala om för läkare eller apotekspersonal om du får en överkänslighetsreaktion (för symtom se avsnitt 4, Eventuella biverkningar). Avbryt behandlingen och kontakta läkare.
Hemofili A
Utveckling av inhibitorer (antikroppar) är en känd komplikation som kan uppträda vid behandling med alla faktor VIII-läkemedel. Inhibitorerna hindrar, särskilt vid höga halter, att behandlingen fungerar som den ska. Du eller ditt barn kommer att övervakas noggrant avseende utveckling av sådana inhibitorer. Om du eller ditt barn drabbas av en blödning som inte kan kontrolleras med Haemate ska du omedelbart tala om det för din läkare.
von Willebrands sjukdom
Vid behandling med von Willebrand-faktor kan antikroppar mot koagulationsfaktorerna utvecklas vilket gör att blödningen inte kan kontrolleras med normala doser. Det är därför viktigt att behandlingens effekt kontrolleras av din läkare.
Berätta för läkare eller apotekspersonal om du har en hjärtsjukdom eller har riskfaktorer för hjärtsjukdom.
Om du behöver en enhet för central venaccess (CVAD) för att tillföra Haemate, finns risk för CVAD-relaterade komplikationer i form av lokala infektioner, bakterier i blodet (bakteriemi) och bildning av en blodpropp i det blodkärl (trombos) där katetern är införd.
Om du har von Willebrands sjukdom finns en ökad risk att få blodpropp (inklusive blodpropp i lungan) vid användning av Haemate. Detta gäller särskilt om du har någon känd riskfaktor för att få blodpropp som t ex tidigare blodpropp, perioder i samband med operation utan förebyggande behandling mot blodpropp, kraftig övervikt, långvarigt sängliggande, cancer, överdosering. Har du någon av dessa riskfaktorer rådfråga din läkare före användning av Haemate.
Virussäkerhet
När läkemedel framställs av human plasma eller blod, vidtas speciella åtgärder för att förhindra att infektioner överförs till patienter. Detta inkluderar:
Noggrant urval av blod- och plasmagivare för att försäkra sig om att personer med risk för att vara smittbärare utesluts.
Test av enskilda donationer och plasmapooler för tecken på virus/infektion.
Inkludering av steg i hanteringen av blodet eller plasman som kan inaktivera och avskilja virus.
Trots detta kan risken för överföring av infektion inte helt uteslutas när läkemedel som tillverkats av humant blod eller plasma ges. Detta gäller även nya, hittills okända virus samt andra typer av infektioner.
De åtgärder som vidtagits anses vara effektiva mot höljeförsedda virus, såsom HIV, hepatit B och hepatit C virus och det icke höljeförsedda viruset hepatit A virus. Åtgärderna kan vara av begränsat värde mot icke höljeförsedda virus såsom parvovirus B19.
Infektion av parvovirus B19 kan vara allvarlig för gravida kvinnor (infektion av foster), individer med försämrat immunförsvar eller patienter med viss typ av anemi (t.ex. hemolytisk anemi).
Din läkare kan komma att föreslå vaccination mot Hepatit A och B om du regelbundet/upprepat behandlas med plasmaderiverade faktor VIII/von Willebrandprodukter.
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Haemate ska inte blandas med andra läkemedel eller spädningsvätskor.
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel.
Vid graviditet och amning ska Haemate endast användas efter särskilt övervägande av behandlande läkare.
Haemate har ingen effekt på förmågan att framföra fordon och använda maskiner.
Haemate 500 IE FVIII / 1200 IE VWF innehåller 26 mg natrium (huvudingrediensen i koksalt/bordssalt) i varje injektionsflaska. Detta motsvarar 1,3 % av högsta rekommenderat dagligt intag av natrium för vuxna.
Haemate 1000 IE FVIII / 2400 IE VWF innehåller 52,5 mg natrium (huvudingrediensen i koksalt/bordssalt) i varje injektionsflaska. Detta motsvarar 2,6 % av högsta rekommenderat dagligt intag av natrium för vuxna.
Använd alltid detta läkemedel enligt läkarens anvisningar. Rådfråga läkare om du är osäker.
Behandlingen kommer att inledas av din läkare. Läkaren kommer att informera dig noggrant om beredning av lösning, injektions-/infusionsteknik samt vilka åtgärder du ska vidta i händelse av allvarliga biverkningar. Så snart du klarar av att behandla dig själv och om inga biverkningar har uppträtt under behandlingen kan din läkare låta dig fortsätta med behandling i hemmet.
Läkaren anpassar dosen individuellt för dig. Ändra inte den dosering och injektionshastighet som din läkare ordinerat.
Allmänna instruktioner för beredning och administrering
Lösningen ska vara klar eller lätt opalescent (halvgenomskinlig). Efter filtrering/fyllning av sprutan (se nedan) men före administrering ska lösningen kontrolleras visuellt med avseende på partiklar och missfärgning. Även om beredningsanvisningarna följs exakt är det inte ovanligt att några fällningar eller partiklar finns kvar i lösningen innan filtrering. Filtret i Mix2Vial-setet avlägsnar dessa partiklar fullständigt. Använd inte lösningar som fortfarande är grumliga eller innehåller partiklar eller flagor efter filtreringen.
Beredning och uppdragning i sprutan måste göras under aseptiska förhållanden (förhindrar förorening med bakterier).
Lösningen ska användas omedelbart efter det att den förts över till sprutan.
Beredning av lösningen och fyllning av sprutan
Värm vätskan till rumstemperatur. Avlägsna plastlocken både från injektionsflaskan med Haemate och injektionsflaskan med vätska. Behandla gummipropparnas ytor med antiseptisk lösning och låt dem torka innan Mix2Vial-förpackningen öppnas.
1 | 1. Öppna Mix2Vial-förpackningen genom att dra av förslutningen. Ta inte ut Mix2Vial-setet ur blisterförpackningen. |
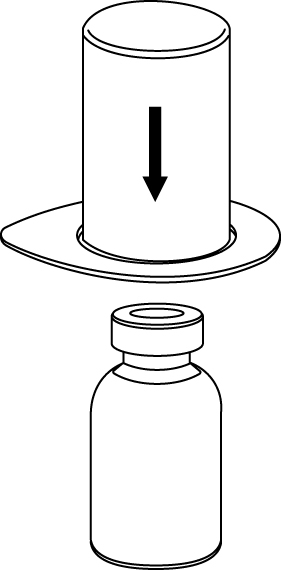 2 | 2. Placera flaskan med vätska på en plan, ren yta och håll fast flaskan stadigt. Ta blisterförpackningen med Mix2Vial-setet och tryck spetsen på den blå adapter-delen rakt ner genom vätskeflaskans propp. |
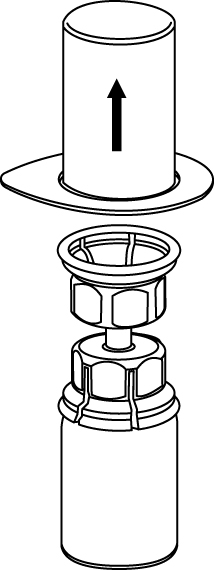 3 | 3. Ta försiktigt bort blisterförpackningen från Mix2Vial-setet genom att ovanifrån ta tag om kanten och dra rakt upp. Se till att endast blisterförpackningen tas bort, inte Mix2Vial-setet. |
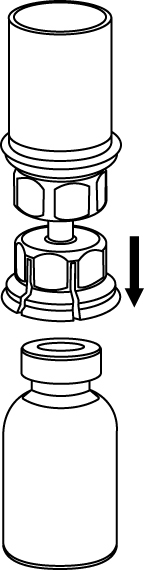 4 | 4. Ställ flaskan med Haemate på ett plant, fast underlag. Vänd vätskeflaskan med det fastsatta Mix2Vial-setet och tryck spetsen på den transparenta adapter-delen rakt ner genom Haemate-flaskans propp. Vätskan kommer automatiskt att rinna över till Haemate-flaskan. |
5 | 5. Fatta tag i den del av Mix2Vial-setet där flaskan med Haemate sitter med ena handen och den del av Mix2Vial-setet där vätskeflaskan sitter med den andra handen och skruva försiktigt isär setet i två delar för att undvika skumbildning. Kassera vätskeflaskan med den blå Mix2Vial-delen fastsatt. |
6 | 6. Rotera Haemate-flaskan med den fastsatta transparenta adaptern försiktigt tills pulvret löst sig fullständigt. Skaka inte flaskan. |
7 | 7. Dra in luft i en tom, steril spruta. Medan flaskan med Haemate står rakt upp kopplas sprutan ihop med Luer-lock-inpassningen på Mix2Vial-delen. Spruta in luft i Haemate-flaskan. |
8 | 8. Med sprutkolven intryckt vänds flaskan (tillsammans med set och spruta) upp och ned. Dra in lösningen i sprutan genom att föra kolven långsamt tillbaka. |
9 | 9. När all lösning har förts över till sprutan, fatta ett fast tag om sprutan (håll sprutan med kolven nedåt) och koppla bort den transparenta Mix2Vial-adaptern från sprutan. |
Administrera lösningen omedelbart långsamt intravenöst (i en ven) med en hastighet som är bekväm (max 4 ml/min) med hjälp av injektionssetet. Var noggrann med att se till att inget blod kommer in i den fyllda sprutan.
Om större mängder ska administreras kan detta ske med infusion (dropp i en ven). Den beredda lösningen från flera injektionsflaskor förs då över till en lämplig infusionspåse eller pump. Om läkemedlet ska ges till dig som infusion görs det av sjukvårdspersonal.
Om du fått i dig för stor mängd läkemedel eller om t ex ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 112) för bedömning av risken samt rådgivning.
Ta omedelbart nästa dos och fortsätt med regelbundna intervall enligt din läkares rekommendation.
Ta inte dubbel dos för att kompensera för glömd dos.
Sluta inte att använda Haemate utan att rådfråga läkare.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare eller apotekspersonal.
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Bland barn som inte behandlats med faktor VIII-läkemedel tidigare är det mycket vanligt att hämmande antikroppar utvecklas (se avsnitt 2) (förekommer hos fler än 1 av 10 patienter). För patienter som tidigare har behandlats med faktor VIII (behandling mer än 150 dagar) är dock risken mindre och komplikationen är mindre vanlig (förekommer hos färre än 1 av 100 användare). Om du eller ditt barn utvecklar antikroppar kan läkemedlen upphöra att fungera som de ska, och du eller ditt barn kan drabbas av ihållande blödningar. Om detta händer ska du omedelbart kontakta läkare.
Sluta ta Haemate och kontakta omedelbart läkare om du får en överkänslighetsreaktion (anafylaktisk chock eller angioödem). Överkänslighetsreaktioner kan ge följande symtom:
svullnad av ansikte, tunga eller svalg
svårigheter att svälja
nässelutslag och andningssvårigheter
pipande andning, tryckkänsla över bröstet
blodtrycksfall
brännande känsla/sveda på injektionsstället
frossa eller värmekänsla
huvudvärk
hjärtklappning
illamående och kräkningar
trötthet
rastlöshet
stickande känsla
Överkänslighetsreaktioner är mycket sällsynta och förekommer hos färre än 1 av 10 000 användare.
Mycket sällsynta (förekommer hos färre än 1 av 10 000 användare):
Feber.
Blodpropp, inklusive propp i lungan. Patienter med von Willebrands sjukdom med kända riskfaktorer löper en ökad risk, se Varningar och försiktighet.
Antikroppar mot von Willebrand faktor, se Varningar och försiktighet.
Har rapporterats (förekommer hos ett okänt antal användare) :
Hemolys (nedbrytning av röda blodkroppar)
Hypervolemi (ökad blodvolym).
Biverkningar hos barn och ungdomar
Biverkningar hos barn förväntas vara samma som hos vuxna.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera eventuella biverkningar direkt till Läkemedelsverket, www.lakemedelsverket.se. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Läkemedelsverket
Box 26
751 03 Uppsala
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras vid högst 25 ºC. Får ej frysas.
Förvara i ytterkartongen. Ljuskänsligt.
Den färdigberedda lösningen ska användas omedelbart.
Använd inte lösningen om den fortfarande är grumlig eller innehåller partiklar eller flagor efter filtreringen.
All oanvänd färdigberedd lösning ska kasseras.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
De aktiva substanserna är:
Ristocetin cofaktor (VWF:RCo) human plasmaderiverad von Willebrand faktor 1200 IE (Internationella Enheter) respektive 2400 IE.
Human koagulationsfaktor VIII 500 IE respektive 1000 IE.
Övriga innehållsämnen i pulvret är humant albumin, glycin, natriumklorid, natriumcitrat, natriumhydroxid eller saltsyra (för pH-justering).
Vätska är vatten för injektionsvätskor.
Läkemedlet är ett vitt eller svagt gult pulver eller sprött fast ämne. Vätskan är ofärgad och klar.
Förpackningsstorlek:
500 IE koagulationsfaktor VIII / 1200 IE von Willebrand faktor: 1x(pulver och 10 ml vätska)
1000 IE koagulationsfaktor VIII / 2400 IE von Willebrand faktor: 1x(pulver och 15 ml vätska)
Kartongen innehåller:
1 injektionsflaska med pulver
1 injektionsflaska med 10 ml eller 15 ml vatten för injektionsvätskor
1 överföringsset med filter 20/20
Tillbehör för administrering (innerkartong):
1 engångsspruta, 10 ml eller 20 ml
1 injektionsset
2 alkoholtorkar
1 plåster
CSL Behring GmbH, Emil-von-Behring-Str. 76, 35041 Marburg, Tyskland
Information lämnas av:
CSL Behring AB, Box 712, 182 17 Danderyd
Denna bipacksedel ändrades senast: 2023-10-02