50 mg pulver till injektionsvätska, lösning
cefuroxim
Källa: Fass.se
Bipacksedel: Information till användaren
50 mg pulver till injektionsvätska, lösning
cefuroxim
Spara denna information, du kan behöva läsa den igen.
Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt 4.
Aprokam innehåller en aktiv substans, cefuroxim (som cefuroximnatrium), ett antibiotikum som tillhör gruppen cefalosporiner. Antibiotika används för att döda de bakterier som orsakar infektioner.
Detta läkemedel kommer att användas om du genomgår en ögonoperation på grund av katarakt (grå starr).
Din ögonkirurg kommer att ge detta läkemedel med en injektion i ögat vid slutet av gråstarroperationen för att förebygga en ögoninfektion.
om du är allergisk mot cefuroxim eller mot något annat antibiotikum som tillhör gruppen cefalosporiner.
Prata med din läkare, apotekspersonal eller sjuksköterska innan du ges Aprokam:
Om du är allergisk mot andra antibiotika som till exempel penicillin.
Om du är i riskzonen för en infektion orsakad av en bakterie kallad meticillinresistent Staphylococcus aureus (MRSA).
Om du är i riskzonen för en allvarlig infektion.
Om du har fått diagnosen komplicerad grå starr.
Om en kombinerad ögonoperation är planerad.
Om du har svår sköldkörtelsjukdom.
Aprokam ges enbart som injektion i ögat (intrakameral användning).
Aprokam ska ges under aseptiska förhållanden (rena och bakteriefria) under gråstarroperation.
En injektionsflaska ska bara användas till en enda patient.
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du får detta läkemedel.
Du kommer bara att behandlas med Aprokam om din läkare anser detta vara nödvändigt.
Aprokam innehåller natrium
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill “natriumfritt”.
Injektioner med Aprokam ges av en ögonkirurg i slutet av en gråstarroperation.
Aprokam tillhandahålls i form av ett sterilt pulver och löses upp i koksaltlösning för injektion före administrering.
Din behandling ges vanligtvis av sjukvårdspersonal. Om du tror att en dos har missats eller att du fått för mycket av läkemedlet, rådfråga din läkare eller sjuksköterska.
Om du har ytterligare frågor om detta läkemedel kontakta läkare, apotekspersonal eller sjuksköterska.
Om du fått i dig för stor mängd läkemedel eller om t.ex. ett barn fått i sig läkemedlet av misstag kontakta läkare, sjukhus eller Giftinformationscentralen (tel. 112) för bedömning av risken samt rådgivning.
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
Följande biverkningar är mycket sällsynta (förekommer hos färre än 1 av 10 000 användare):
Allvarlig allergisk reaktion som medför svårigheter att andas eller yrsel.
Följande biverkning har rapporterats:
Makulaödem (suddig eller vågig syn nära eller i mitten av ditt synfält).
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera eventuella biverkningar direkt till Läkemedelsverket, www.lakemedelsverket.se. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Läkemedelsverket
Box 26
751 03 Uppsala
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på ytterkartongen och etiketten på injektionsflaskan efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras vid högst 25°C. Förvara injektionsflaskan i ytterkartongen. Ljuskänsligt.
För engångsbruk.
Efter beredning ska läkemedlet användas omedelbart.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Den aktiva substansen är cefuroxim (som cefuroximnatrium).
En injektionsflaska innehåller 50 mg cefuroxim.
Efter beredning innehåller 0,1 ml lösning 1 mg cefuroxim.
Inga andra innehållsämnen ingår.
Aprokam är ett vitt till nästan vitt pulver för injektionslösning i injektionsflaskor.
Förpackningen innehåller 1, 10 eller 20 injektionsflaskor eller 10 injektionsflaskor tillsammans med 10 stycken sterila filterkanyler. Alla förpackningsstorlekar kommer eventuellt inte att marknadsföras.
Innehavare av godkännande för försäljning:
Laboratoires Thea
12, rue Louis Blériot
63017 Clermont-Ferrand Cedex 2
Frankrike
Tillverkare:
Biopharma S.R.L.
Via Delle Gerbere, 22/30 (loc. S. Palomba)
00134 Rom (RM)
Italien
eller
Laboratoires Thea
12, rue Louis Blériot
63017 Clermont-Ferrand Cedex 2
Frankrike
Detta läkemedel är godkänt i medlemsstaterna i EES under följande namn:
Österrike, Belgien, Tjeckien, Danmark, Finland, Frankrike, Tyskland, Italien, Island, Luxemburg, Nederländerna, Norge, Polen, Portugal, Rumänien, Slovakien, Slovenien, Sverige, Storbritannien | Aprokam |
Cypern, Grekland, Spanien | Prokam |
Irland | Aprok |
Inkompatibiliteter
Inga inkompatibiliteter med de mest använda produkterna vid kataraktkirurgi har rapporterats i litteraturen. Detta läkemedel får inte blandas med andra läkemedel utom de som nämns nedan [natriumklorid 9 mg/ml (0,9 %) lösning för injektion].
Beredning och administrering av Aprokam
Engångsbehållare för enbart intrakameral användning.
Aprokam ska efter beredning ges som intraokulär injektion i ögats främre kammare (intrakameral injektion) av en ögonkirurg under rekommenderade aseptiska förhållanden vid kataraktkirurgi.
Den beredda lösningen ska inspekteras visuellt och ska bara användas om den är en färglös till gulaktig lösning, fri från synliga partiklar.
Läkemedlet ska användas omedelbart efter beredning och inte sparas för senare användning.
Den rekommenderade dosen av cefuroxim är 1 mg i 0,1 ml natriumklorid 9 mg/ml (0,9 %) injektionslösning.
INJICERA INTE MER ÄN DEN REKOMMENDERADE DOSEN
Injektionsflaskan är för engångsbruk.
En injektionsflaska för endast en patient. Klistra in flagg-etiketten från flaskan i patientjournalen.
För beredning av Aprokam för intrakameral administrering, var god se följande instruktioner: | |
|---|---|
Skall desinficeras | 1. Kontrollera att ”flip-off”-locket är intakt innan det avlägsnas. |
 | 2. Desinficera ytan på gummiproppen före steg 3. |
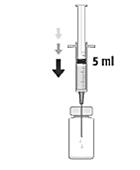 | 3. Håll injektionsflaskan upprätt och tryck in den sterila kanylen vertikalt genom mitten av injektionsflaskans gummipropp. Injicera 5 ml natriumklorid 9 mg/ml (0,9 %) injektionsvätska aseptiskt. |
| 4. Skaka försiktigt tills lösningen är fri från partiklar. |
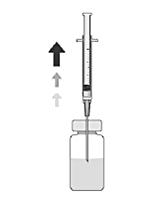 kanyl med ett 5 µm filter | 5. Fäst en steril kanyl (18G x 1½”, 1.2 mm x 40 mm) försedd med ett 5‑mikrometerfilter (membran av akrylsampolymer på fiberduk av nylon) på en 1 ml steril spruta (den sterila kanylen med 5‑mikrometerfilter kan finnas tillgänglig i förpackningen). Håll injektionsflaskan upprätt och tryck därefter in den 1 ml sterila sprutan vertikalt genom mitten av injektionsflaskans gummipropp. |
minst 0,1 ml | 6. Minst 0,1 ml av lösningen dras aseptiskt upp i sprutan. |
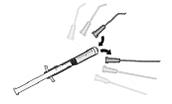 | 7. Avlägsna nålen från sprutan och fäst en steril främre-kammare kanyl på sprutan. |
 | 8. Tryck försiktigt ut luften från sprutan och ställ in dosen på 0,1 ml strecket på sprutan. Sprutan är nu klar för injektion. |
Efter användning ska överbliven lösning kasseras. Spara den inte för senare användning. | |
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar. Kassera använda kanyler i behållare avsedda för vassa föremål.
Denna bipacksedel godkändes senast: 2019-08-21